
Năm 1960, nước Mỹ đã gặp một sự may mắn. Không phải may vì thành tựu quan trọng nào đó hay tránh được thiên tai, bão lũ. Nhưng nó còn quý giá hơn cả, là bởi một thảm họa kinh hoàng đã được ngăn chặn kịp thời. Tất cả nhờ công của một người phụ nữ.
Ngày đó, thuốc thalidomide được bán cho phụ nữ mang thai với mục đích chống buồn nôn, giảm cơn ốm nghén. Nước Mỹ đã may mắn thoát được cuộc khủng hoảng dị tật liên quan đến thalidomide. Vì sao vậy?
Đó là khi hồ sơ xin bắt đầu bán đại trà thuốc thalidomide ở Mỹ được đặt trên bàn của nữ tiến sĩ Frances Oldham Kelsey. Bà Kelsey mới chỉ vừa về làm việc tại Cục Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) được 1 tháng.
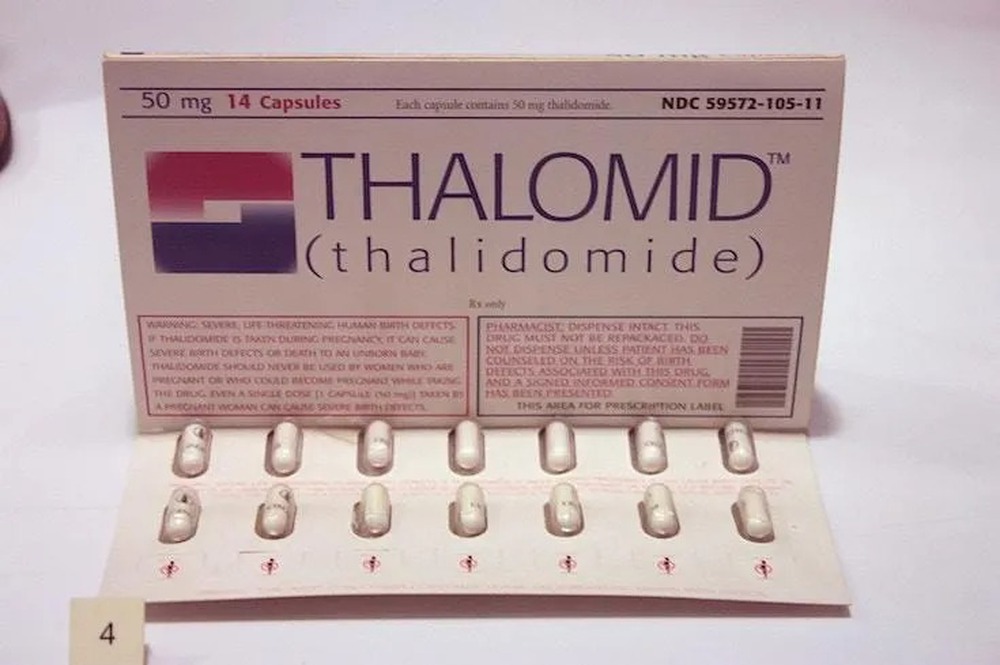
Ngày nay, chúng ta đều biết rõ rằng loại thuốc này có thể gây ra một loạt dị tật bẩm sinh nghiêm trọng và thậm chí tử vong ở trẻ sơ sinh. Nhưng ngược dòng thời gian khoảng hơn 60 năm trước, tác dụng phụ "đáng sợ" của thalidomide không hề được biết đến.
Với tư cách là người đánh giá y tế, bà Kelsey có quyền ngăn chặn một loại thuốc đưa ra thị trường nếu bà nhận thấy hồ sơ đăng ký thiếu bằng chứng đầy đủ về sự an toàn.
Sau khi xem xét kỹ lưỡng, Kelsey đã từ chối hồ sơ cấp phép cho thuốc thalidomide lưu hành trên thị trường với lý do thiếu bằng chứng đầy đủ về sự an toàn thông qua các thử nghiệm lâm sàng nghiêm ngặt.
Động thái đó tưởng chừng như quá khắt khe, có phần bảo thủ, đối với một loại thuốc đã được sử dụng rộng rãi ở nhiều quốc gia trên thế giới. Nhưng khoan hãy chỉ trích, vì kết cục là điều không ai ngờ...
Được nhận làm việc vì bị nhầm là... đàn ông
Với trình độ y học như hiện nay, việc kiểm định xem một loại thuốc có đủ an toàn hay không là điều dễ dàng. Nhưng trở về thời gian nửa thế kỷ trước, đó là câu chuyện rất khác.
Sau khi hoàn thành bằng thạc sĩ dược học tại Đại học McGill ở quê hương Canada, bà Kelsey được giáo sư, người từng làm cố vấn cho luận văn tốt nghiệp, giới thiệu đến tiến sĩ Eugene Geiling tại Đại học Chicago để xin vào làm tại vị trí trợ lý nghiên cứu, đồng thời bày tỏ mong muốn được học lên tiến sĩ.

Frances Kelsey làm việc với tiến sĩ Geiling tại Khoa Dược tại Đại học Chicago, vào khoảng cuối những năm 1930.
Tiến sĩ Geiling, một nhà khoa học làm việc tại FDA, là người nổi tiếng với những nghiên cứu về tuyến yên. Sau khi nhận được thư của bà Kelsey, tiến sĩ Geiling đã viết thư hồi đáp đồng ý để Kelsey làm trợ lý nghiên cứu và trao học bổng để theo học tiến sĩ.
Bước tiến quan trọng đó trong sự nghiệp của Kelsey hóa ra lại là sự nhầm lẫn của tiến sĩ Geiling. Trong cuốn hồi ký ngắn “Autobiographical Reflections”, bà Kelsey mô tả tiến sĩ Geiling là người “rất bảo thủ và cổ hủ”. Bà nhấn mạnh: “Ông ấy thực sự không quan tâm nhiều đến phụ nữ với tư cách là nhà khoa học".
Điều này có thể giải thích tại sao trong bức thư trả lời gửi cho Kelsey, ông đã viết “Mr. Oldham”. Thì ra, tiến sĩ Geiling tin rằng Kelsey là một người đàn ông nên mới chấp nhận bà đến theo học.
Kelsey cho biết bà đã tự hỏi rằng "nếu tên mình là Elizabeth hay Mary Jane, liệu mình có đạt được bước tiến lớn đầu tiên đó không".
Kelsey lần đầu tiên được giới thiệu về sự nguy hiểm của dược phẩm không an toàn được bán đại trà trên thị trường vào năm 1937, khi FDA nhờ tiến sĩ Geiling giải quyết bí ẩn về loại thuốc được mệnh danh "thuốc tiên", có tên Sulfanilamide.
Sulfanilamide chống nhiễm trùng hiệu quả, nhưng nó có dạng viên to và đắng, cần được uống với liều lượng lớn. Để làm cho thuốc hấp dẫn hơn, đặc biệt là đối với trẻ em, các nhà sản xuất đã thêm nó vào dung môi có hương vị quả mâm xôi nhân tạo.
Vấn đề ở chỗ dung môi họ chọn là diethylene glycol - thường được gọi là chất chống đông. Từ tháng 9 đến tháng 10, loại thuốc này đã giết chết 107 người.
Tiến sĩ Geiling và phòng thí nghiệm gồm các nghiên cứu sinh của ông, bao gồm cả Kelsey, bắt đầu xác định chính xác thứ gì trong "thuốc tiên" đã giết người: Dung môi, hương vị hay sulfanilamide. Thông qua một loạt nghiên cứu trên động vật, vào thời điểm đó luật liên bang không bắt buộc phải đưa thuốc ra thị trường, tiến sĩ Geiling và phòng thí nghiệm của ông đã có thể xác định rằng chính diethylene glycol là nguyên nhân gây ra cái chết.
Sự phản ứng kịch liệt của công chúng đối với thảm kịch này đã khiến Quốc hội thông qua "Đạo luật Thực phẩm, Dược phẩm và Mỹ phẩm Liên bang" năm 1938. Trong đó yêu cầu các nhà sản xuất phải đưa ra bằng chứng kiểm định độ an toàn một loại thuốc trước khi đưa ra thị trường.
Mặc dù luật mới này được đưa ra để yêu cầu thử nghiệm trước khi phân phối một loại thuốc mới nhưng nhà sử học John Swann của FDA cho biết “luật không quy định một cách rõ ràng hoặc chi tiết cách thức giám sát việc thử nghiệm đó nên được tiến hành như thế nào”.
Nói cách khác, các thử nghiệm lâm sàng thực hiện qua loa hoặc không có sự giám sát nào.
Bà Kelsey tốt nghiệp trường y năm 1950, và tiếp tục làm việc cho Tạp chí của Hiệp hội Y khoa Mỹ trước khi bắt đầu làm việc tại FDA vào năm 1960. Ở đó, bà là một trong 3 người chịu trách nhiệm xác định độ an toàn của một loại thuốc trước khi được bán ra thị trường.
Các nhà hóa học phải xem xét thành phần hóa học của thuốc và cách nhà sản xuất có thể đảm bảo tính nhất quán của nó, trong khi các nhà dược học xem xét các thử nghiệm trên động vật cho thấy loại thuốc này an toàn.
Mặc dù đây có vẻ là một quá trình kiểm tra nghiêm ngặt và kỹ lưỡng, Kelsey đã thừa nhận một số điểm yếu trong hồi ký của mình. Thiếu sót đáng lo ngại nhất trong quy trình là thời hạn 60 ngày để phê duyệt hoặc từ chối thuốc: Nếu qua ngày thứ 60, thuốc sẽ tự động được tung ra thị trường. Bà nhớ lại rằng điều này đã xảy ra ít nhất một lần.
Cứu tinh của cả đất nước
Theo tài liệu “Bảo vệ sức khỏe Mỹ: FDA, Kinh doanh, và Quy chế ” của Philip J. Hilts (New York: Alfred A. Knopf, 2003), hãng dược phẩm Đức Chemie Grünenthal giới thiệu thalidomide lần đầu tiên - dưới tên thương mại Contergan - tại thị trường Đức vào ngày 1/10/1957, như thứ thuốc an thần điều trị chứng mất ngủ, giảm buồn nôn liên quan đến thai kỳ. Đến năm 1960, thuốc được bán rộng rãi trên hơn 20 quốc gia ở châu Âu và châu Phi.
Tại thời điểm phát triển của loại thuốc này, các nhà khoa học không tin bất kỳ loại thuốc nào được uống bởi phụ nữ mang thai có thể vượt qua hàng rào nhau thai và gây tổn hại cho bào thai đang phát triển.

Khi tiến hành bán thuốc ở thị trường Mỹ, nhà sản xuất thuốc Richardson-Merrell cũng phải gửi hồ sơ xin cấp phép cho Kevadon - tên thương mại của thalidomide tại Mỹ.
Đối với bà Kelsey và những người đánh giá khác, thalidomide đã không vượt qua vòng kiểm tra. Không chỉ có các vấn đề về dược lý, mà Kelsey còn nhận thấy các thử nghiệm lâm sàng còn thiếu sót. Báo cáo của bác sĩ quá ít và chúng chủ yếu dựa trên lời chứng thực của bác sĩ hơn là nghiên cứu khoa học xác đáng. Bà từ chối hồ sơ.
Các báo cáo về tác dụng phụ của thalidomide là viêm dây thần kinh ngoại biên được đăng trên tạp chí Y học Anh số ra tháng 12 năm 1960. Điều này thậm chí còn làm dấy lên một dấu hiệu cảnh báo lớn hơn đối với Kelsey: “Viêm dây thần kinh ngoại biên dường như không phải là loại tác dụng phụ có thể đến từ một viên thuốc ngủ đơn giản”.
Bà đã hỏi thêm thông tin từ nhà sản xuất Richardson-Merrell, và nhận được câu trả lời rằng thalidomide an toàn hơn thuốc an thần. Kelsey sau đó đã gửi một bức thư trực tiếp cho phía Merrell nói rằng bà nghi ngờ họ biết về chất độc thần kinh dẫn đến viêm dây thần kinh nhưng đã chọn không tiết lộ nó trong hồ sơ xin cấp phép.

Merrell gây áp lực cho bà Kelsey chỉ vì không chấp nhận cho bán đại trà thalidomide dù loại thuốc này đã được sử dụng ở hơn 40 quốc gia khác.
Nếu độc tính thần kinh phát triển ở những người trưởng thành dùng thalidomide, Kelsey tự hỏi: Điều gì đang xảy ra với thai nhi của một phụ nữ mang thai dùng thuốc? Mối quan tâm của bà đánh vào tác động nguy hiểm nhất của thalidomide ở các quốc gia khác.
Đến tháng 11 năm 1961, các bác sĩ ở Đức và Úc đã phát hiện dị tật bẩm sinh ở trẻ sơ sinh có mẹ dùng thalidomide trong thời kỳ đầu mang thai. Trong phôi thai, thalidomide có thể gây tổn hại nghiêm trọng đến sự phát triển của các cơ quan, thậm chí chỉ một viên thuốc cũng có thể dẫn đến dị tật ở trẻ sơ sinh.
Và kể từ khi nhiều bác sĩ kê toa thuốc thalidomide để điều trị chứng ốm nghén, 10.000 trẻ sơ sinh trên khắp thế giới đã bị ảnh hưởng và vô số trẻ khác đã chết khi chưa kịp chào đời. Từ năm 1957 đến năm 1962, loại thuốc này đã khiến hàng nghìn trẻ sơ sinh ở Canada, Anh và Tây Đức sinh ra với dị tật nghiêm trọng, bao gồm cả việc rút ngắn hoặc mất tứ chi.
Nhà sản xuất Richardson-Merrell cuối cùng đã tự rút đơn vào tháng 4 năm 1962. Nhưng loại thuốc này đã được phân phối cho “hơn 1.200 bác sĩ, khoảng 15.000-20.000 bệnh nhân, trong số đó có hơn 600 người đang mang thai”.

Ở Mỹ, 17 trường hợp dị tật bẩm sinh đã được báo cáo, nhưng con số đó có thể lên tới hàng nghìn trường hợp nếu FDA (cụ thể là bà Kelsey) không tập trung vào bằng chứng về sự an toàn mà luật yêu cầu (bất chấp áp lực liên tục từ nhà sản xuất thuốc).
Năm 1962, ngay sau khi Richardson-Merrell rút hồ sơ và sự nguy hiểm của loại thuốc này đã được quốc tế biết đến, Quốc hội Mỹ đã thông qua Bản sửa đổi Kefauver-Harris.
Sửa đổi quan trọng này yêu cầu giám sát nhiều hơn đối với các nghiên cứu lâm sàng, bao gồm cả sự đồng ý của bệnh nhân trong các nghiên cứu và bằng chứng khoa học về hiệu quả của thuốc chứ không chỉ về độ an toàn của nó.
Sau khi nó được thông qua, Tổng thống Kennedy đã trao cho bà Kelsey giải thưởng cho đóng góp dân sự tiêu biểu toàn liên bang vì sự đấu tranh dũng cảm của bà góp phần ngăn chặn thảm họa thalidomide xảy ra tại Mỹ.

Trong cuốn hồi ký của mình, Kelsey nói rằng vinh dự đó không chỉ thuộc về riêng bà. “Tôi nghĩ rằng tôi đã thay mặt cho rất nhiều nhân viên khác nhận huy chương”, bà viết. “Đây thực sự là nỗ lực của cả nhóm”.
Bà nhanh chóng được thăng chức trưởng phòng nghiên cứu ma túy vào năm 1963, và 4 năm sau, bà trở thành Giám đốc Văn phòng Điều tra Khoa học - vị trí mà bà đã giữ trong 40 năm cho đến khi nghỉ hưu ở tuổi 90. Bà sống đến 101 tuổi, và qua đời vào năm 2015.
Kelsey đã dành phần lớn cuộc đời của mình để phục vụ cộng đồng và câu chuyện của bà tiếp tục nổi bật như một minh chứng cho vai trò của FDA trong việc đảm bảo sự an toàn của thuốc.
Nguồn: Smithsonianmag
