Cục Quản lý dược (Bộ Y tế) vừa có văn bản gửi Giám đốc Sở Y tế Cần Thơ yêu cầu báo cáo việc thay thế thuốc gây tê Bupivacain.
Văn bản do ông Nguyễn Tất Đạt, Phó Cục trưởng Cục Quản lý dược, ký nêu rõ qua phản ánh tại một số báo điện tử liên quan đến việc sản phụ tử vong nghi do thuốc gây tê Bupivacaine Wpw Spinal 0,5%, trong đó có đề cập thông tin qua phỏng vấn lãnh đạo Sở Y tế Cần Thơ và được thông tin từ tháng 4-2019, Sở y tế Cần Thơ đã có báo cáo Cục Quản lý dược về việc thay thế thuốc gây tê nêu trên.
Tuy nhiên, qua kiểm tra văn bản từ giai đoạn tháng 4-2019 đến nay, Cục này không nhận được văn bản nào của Sở Y tế Cần Thơ liên quan đến việc thay thế thuốc trên.
Liên quan đến nội dung này, Cục Quản lý dược đề nghị Giám đốc Sở Y tế Cần Thơ báo cáo bằng văn bản gửi về cơ quan này trong ngày 25-11.
Trước đó, sau khi có một số trường hợp sản phụ tử vong sau khi sử dụng thuốc gây tê Bupivacaine Wpw Spinal 0,5% heavy, lãnh đạo Sở Y tế Cần Thơ cho biết ngành y tế Cần Thơ đã chủ động thay thế thuốc gây tê Bupivacaine Wpw Spinal 0,5% heavy bằng một loại thuốc khác do Pháp sản xuất từ tháng 4-2019.
Theo lãnh đạo Sở Y tế Cần Thơ, trước đó vào tháng 4, trong các cuộc họp chuyên ngành Sở có nghe tỉnh Long An và Bến Tre phản ánh về sự cố chết người tại địa phương liên quan đến thuốc Bupivacaine Wpw Spinal 0,5% heavy.
Các địa phương nhận thấy hiệu quả giảm đau của thuốc này không hoàn toàn, làm tụt huyết áp kéo dài và một số trường hợp gây sốc, co giật (theo báo cáo của Hội Gây mê khu vực phía Nam và một số bệnh viện tại Cần Thơ).
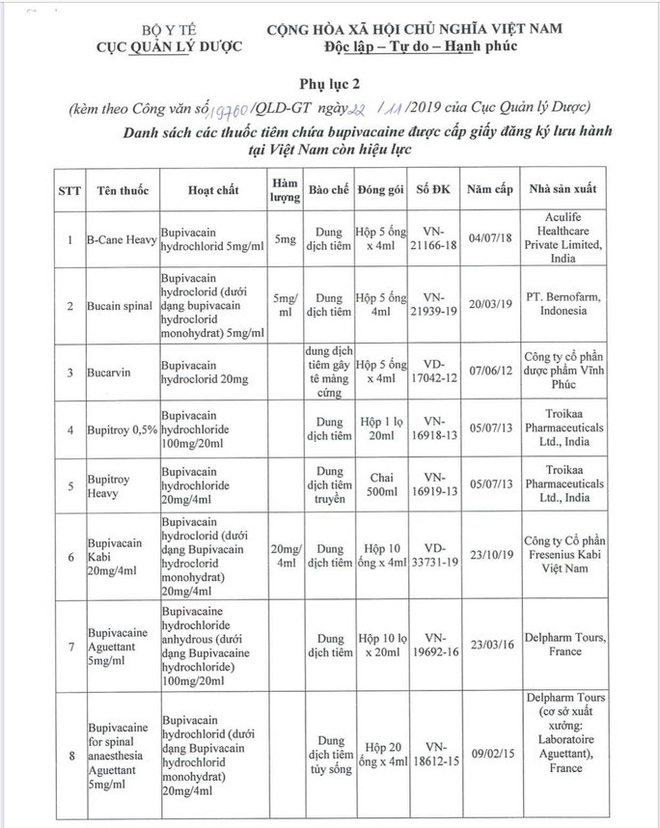
Bộ Y tế cung cấp danh sách cơ sở sản xuất thuốc chứa Bupivacaine được lưu hành tại Việt Nam
Cục Quản lý dược cũng vừa có văn bản gửi sở y tế và các bệnh viện về đảm bảo cung ứng xử dụng thuốc tiêm có chứa Bupivacaine phục vụ nhu cầu khám chữa bệnh.
Theo đó, Sở Y tế các địa phương chỉ đạo cơ sở khẩn trương rà soát công tác mua sắm thuốc, đảm bảo cung ứng kịp thời trong trường hợp cần thay thế thuốc đã trúng thầu; chủ động liên hệ với các cơ sở kinh doanh để được cung ứng thuốc.
Trong trường hợp không lựa chọn được nhà thầu cung ứng thông qua hình thức đấu thầu rộng rãi, các cơ sở có thể áp dụng hình thức lựa chọn nhà thầu phù hợp như: Mua sắm trực tiếp, chỉ định thầu...
Theo Cục Quản lý dược, có 18 loại thuốc tiêm chứa Bupivacaine được cấp giấy phép đăng ký lưu hành tại Việt Nam còn hiệu lực.
Trước đó, 2 sản phụ tử vong và 1 sản phụ nguy kịch sau khi được dùng thuốc gây tê Bupivacaine WPW Spinal 0,5% Heavy do Công ty cổ phần Dược phẩm trung ương CPC I tại Đà Nẵng cung ứng.
Hiện, Bộ Y tế đã lập Hội đồng điều tra, thẩm định và làm rõ. Một số địa phương đã dừng sử dụng thuốc gây tê Bupivacaine WPW Spinal 0,5% Heavy do Công ty cổ phần Dược phẩm Trung ương CPC I tại Đà Nẵng cung ứng và chuyển sang thuốc khác.