Tơ nhện được cho là một trong những vật liệu bền nhất, dai nhất trên Trái đất. Giờ đây, các kỹ sư tại Đại học Washington ở St. Louis đã thiết kế sợi tơ protein amyloid và sản xuất chúng từ vi khuẩn đã được biến đổi gen. Các sợi này chắc chắn và dai hơn một số loại tơ nhện tự nhiên.
Nói một cách chính xác, tơ nhân tạo - được gọi là sợi “polyme amyloid” - không phải do các nhà nghiên cứu sản xuất, mà bởi vi khuẩn được biến đổi gen trong phòng thí nghiệm của Fuzhong Zhang, giáo sư tại Khoa Năng lượng, Môi trường & Kỹ thuật Hóa học tại Trường Kỹ thuật McKelvey.
Zhang đã làm việc với tơ nhện trước đây. Vào năm 2018, phòng thí nghiệm của ông đã thiết kế vi khuẩn tạo ra tơ nhện tái tổ hợp với hiệu suất ngang bằng với các loại tơ tự nhiên về tất cả các đặc tính cơ học quan trọng.
Zhang nói: “Sau công trình trước đây của chúng tôi, tôi tự hỏi liệu chúng tôi có thể tạo ra thứ gì đó tốt hơn tơ nhện bằng cách sử dụng nền tảng sinh học tổng hợp của chúng tôi”.

Sợi tạo ra bởi vi khuẩn
Nhóm nghiên cứu, bao gồm tác giả Jingyao Li, một nghiên cứu sinh tại phòng thí nghiệm của Zhang, đã sửa đổi trình tự axit amin của protein tơ nhện để tạo các đặc tính mới, đồng thời giữ một số đặc điểm hấp dẫn của tơ nhện.
Một vấn đề liên quan đến sợi tơ nhện tái tổ hợp - mà không có sự thay đổi đáng kể từ chuỗi tơ nhện tự nhiên - là nhu cầu tạo ra tinh thể β-nano, một thành phần chính của tơ nhện tự nhiên, góp phần vào sức mạnh của nó. Zhang cho biết: “Nhện đã tìm ra cách quay sợi với một lượng tinh thể nano chính xác. Nhưng khi con người sử dụng quy trình kéo sợi nhân tạo, lượng tinh thể nano trong sợi tơ tổng hợp thường thấp hơn so với sợi tơ tự nhiên.”

Tơ nhện được cho là một trong những vật liệu bền nhất, dai nhất trên Trái đất
Để giải quyết vấn đề này, nhóm nghiên cứu đã thiết kế lại trình tự tơ bằng cách đưa vào các trình tự amyloid để hình thành tinh thể β-nano. Họ đã tạo ra các protein amyloid cao phân tử khác nhau bằng cách sử dụng ba trình tự amyloid đã được nghiên cứu kỹ lưỡng làm đại diện.
Các protein thu được có trình tự axit amin ít lặp lại hơn so với tơ nhện, do đó vi khuẩn đã được biến đổi gen dễ dàng tạo ra chúng hơn. Cuối cùng, vi khuẩn đã tạo ra một protein amyloid cao phân tử với 128 đơn vị lặp lại.
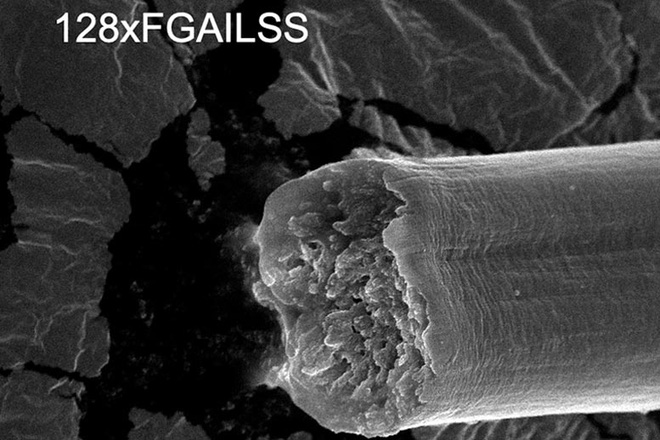
Sợi amyloid cao phân tử với 128 protein lặp lại
Protein càng dài, sợi tạo thành càng chắc và dai. 128 protein lặp lại tạo ra sợi có độ bền gigapascal (thước đo lực cần thiết để phá vỡ sợi có đường kính cố định), bền hơn thép thông thường. Độ dai của sợi (thước đo lượng năng lượng cần thiết để làm đứt sợi) cao hơn Kevlar và tất cả các sợi tơ tái tổ hợp trước đó. Sức mạnh và độ dẻo dai của nó thậm chí còn cao hơn một số loại sợi tơ nhện tự nhiên.
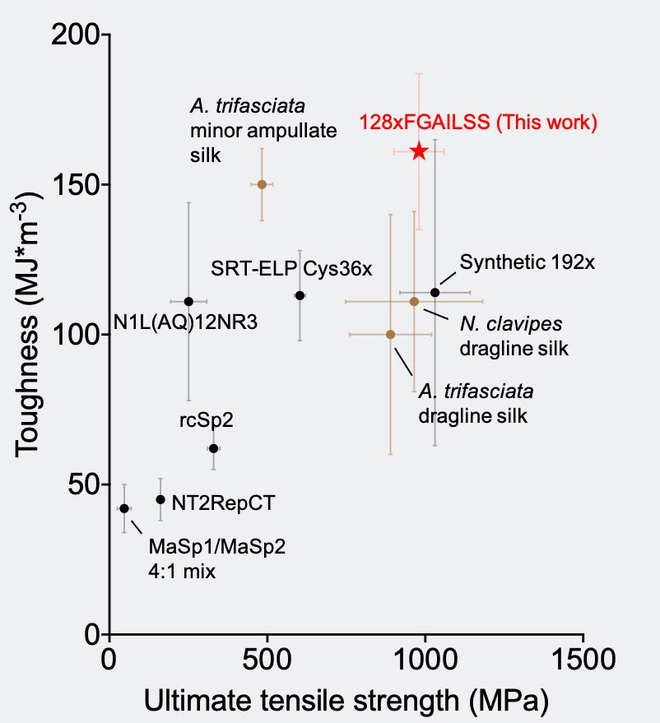
Phối hợp với Young- Shin Jun, giáo sư Khoa Năng lượng, Môi trường & Kỹ thuật Hóa học, và nghiên cứu sinh Yaguang Zhu, nhóm nghiên cứu đã xác nhận rằng tính chất cơ học cao của các sợi amyloid cao phân tử thực sự đến từ số lượng tinh thể β-nano được tăng cường.
Những protein mới này và các sợi tạo thành không phải là phần cuối của câu chuyện về sợi tổng hợp hiệu suất cao trong phòng thí nghiệm. Họ chỉ mới bắt đầu. Zhang nói: “Điều này chứng tỏ rằng chúng ta có thể thiết kế sinh học để tạo ra các vật liệu đánh bại vật liệu tốt nhất trong tự nhiên”.
Công trình nghiên cứu này chỉ khám phá ba trong số hàng nghìn trình tự amyloid khác nhau có khả năng tăng cường các đặc tính của tơ nhện tự nhiên. Có khả năng các nhà nghiên cứu có thể sử dụng các chuỗi khác, đưa chúng vào thiết kế đã có và cũng có được sợi nâng cao hiệu suất.
Tham khảo: ScitechDaily